臨床成績
国内第Ⅰ/Ⅱa相試験(GD2-PⅠ試験)、国内第Ⅱb相試験(GD2-PⅡ試験)及び海外第Ⅲ相試験(DIV-NB-301試験)は一部国内での承認内容と異なる成績が含まれていますが、承認時評価資料のため掲載します。
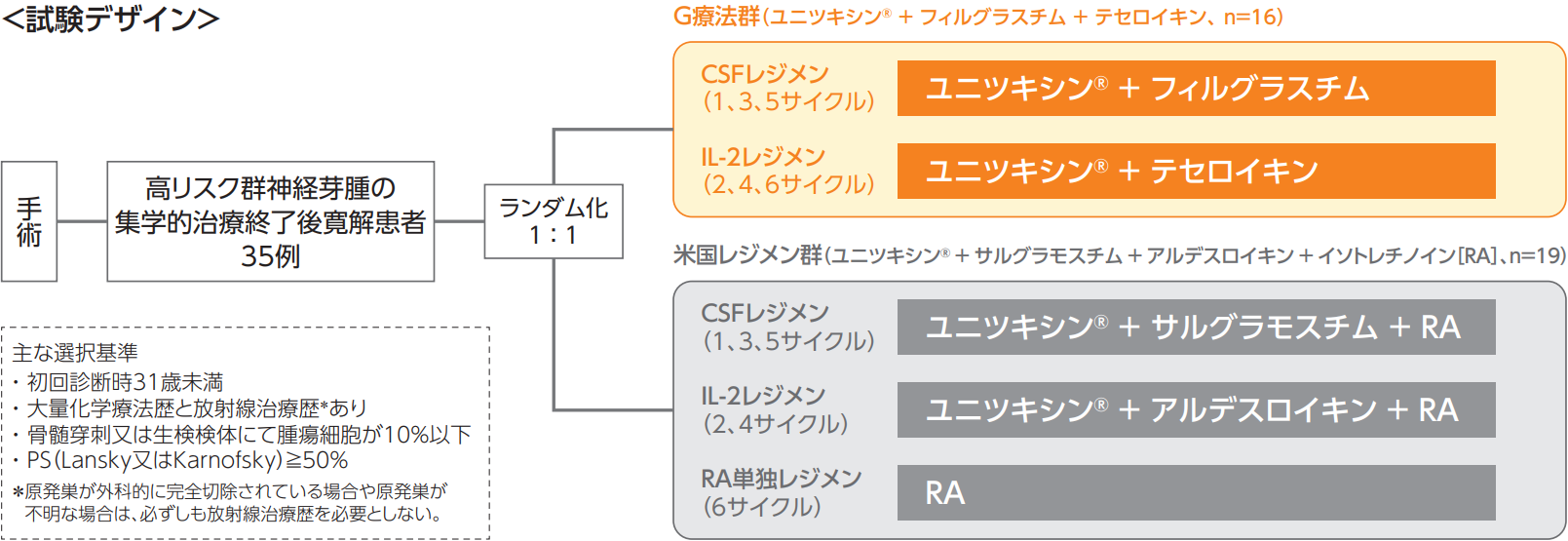
国内第Ⅱb相試験(GD2-PⅡ試験)
(無作為化、非盲検、多施設共同、並行群間比較試験、2016-2019年)
承認時評価資料:国内第Ⅱb相試験(GD2-PⅡ試験)
[目 的]
高リスク群神経芽腫の集学的治療終了後寛解患者に対する維持療法として、米国レジメン群(ユニツキシン、サルグラモスチム、アルデスロイキン、イソトレチノインを併用)との比較で、日本レジメン群(以下、G療法群:ユニツキシン、フィルグラスチム、テセロイキンを併用[DIN/FIL/TEC群])の有用性を評価する。
[対 象]
高リスク群神経芽腫の集学的治療終了後寛解患者35例
有効性解析対象集団:full analysis set(FAS)35例(G療法群:16例、米国レジメン群:19例)
安全性解析対象集団:safety analysis set(SAS)35例(G療法群:16例、米国レジメン群:19例)
[方 法]
G療法群、米国レジメン群ともに1サイクルあたり28±4日(次サイクル開始が延期の場合最大49日間)のサイクル治療を計6サイクル実施した。
非表示部分は左右にスクロールして表示してください。
G療法群
1、3、5サイクル
(Day1-14)
・フィルグラスチム 5μg/kgを皮下注射。
(Day4-7)
・フィルグラスチム投与終了1時間後に、 ユニツキシン17.5mg/m2を10~20時間で点滴投与。
2、4、6サイクル
(Day1-4)
・テセロイキン75万単位/m2を24時間で点滴投与。
(Day8-11)
・テセロイキン100万単位/m2を24時間で点滴投与。
・テセロイキン投与開始約2時間後に、ユニツキシン17.5mg/m2を10~20時間で点滴投与。
米国レジメン群
1、3、5サイクル
(Day1-14)
・サルグラモスチム250μg/m2を皮下注射。
(Day4-7)
・サルグラモスチム投与終了1時間後に、ユニツキシン17.5mg/m2を10~20時間で点滴投与。
(Day11-24)
・RA 160mg/m2(体重12kg超)又は5.33mg/kg(体重12kg以下)を分2にて内服。
2、4サイクル
(Day1-4)
・アルデスロイキン300万IU/m2を24時間で点滴投与。
(Day8-11)
・アルデスロイキン450万IU/m2を24時間で点滴投与。
・アルデスロイキン投与開始約2時間後に、ユニツキシン17.5mg/m2を10~20時間で点滴投与。
(Day15-28)
・RA 160mg/m2(体重12kg超)又は 5.33mg/kg(体重12kg以下)を分2にて内服。
6サイクル
(Day1-14)
・5サイクルのRA最終内服日から11日以上経過後に、RA 160mg/m2(体重12kg超)又は5.33mg/kg(体重12kg以下)を分2にて内服。
※なお、臨床試験におけるユニツキシン投与時の支持療法は以下の通りで設定されていた。
・抗ヒスタミン剤による支持療法:
血管浮腫や血清病様症状を伴うアレルギーに対し、ヒドロキシジン0.5~1mg/kg(最大50mg)を本剤の投与10~30分前を目安に投与し、以後4~6時間ごとを目安に本剤の投与終了まで定期投与した。
・解熱鎮痛剤による支持療法:
血管浮腫や血清病様症状を伴うアレルギーに対し、アセトアミノフェン10mg/kg(最大650mg)を本剤の投与10~30分前を目安に投与した。以後は発熱が発現した場合又は2、4、6サイクルにおける本剤の投与日に、4~6時間ごと1日4回を目安に継続投与した。
・オピオイド等による支持療法:
神経性障害性疼痛に対し、モルヒネ持続投与又はリドカイン持続投与+モルヒネ間欠投与を行った。モルヒネ持続投与では、モルヒネ塩酸塩を本剤の投与直前にローディング後、20~50μg/kg/hを目安に持続投与を開始し、本剤の投与終了後2時間を目安に投与を終了した。リドカイン持続投与+モルヒネ間欠投与では、リドカイン2mg/kgを本剤の投与直前に30分かけてローディングし、本剤の投与終了後2時間を目安にリドカイン1mg/kg/hで持続投与し、疼痛が発現した場合は、モルヒネ1時間量を目安とした用量で、2時間を目安にボーラス投与した。なお、モルヒネに耐容のない場合(そう痒感や蟻走感等)は、オピオイドローテーションに準じて、フェンタニル、オキシコドン等に変更又はリドカイン持続投与+モルヒネ間欠投与に変更した。
※本試験の米国レジメン群で使用されているサルグラモスチム、アルデスロイキン、イソトレチノインは国内未承認の薬剤です。また、支持療法で使用されている薬剤の使用については、各製品の「効能又は効果」、「用法及び用量」を最新の添付文書にてご参照ください。
※国内におけるユニツキシン点滴静注17.5mg/5mLの承認された用法及び用量は「フィルグラスチム(遺伝子組換え)及びテセロイキン(遺伝子組換え)との併用において、通常、ジヌツキシマブ(遺伝子組換え)として1日1回17.5mg/m2(体表面積)を10~20時間かけて点滴静注する。28日間を1サイクルとし、1、3、5サイクルは4~7日目、2、4、6サイクルは8~11日目に投与する。」です。
[評価項目]
主要評価項目:
無イベント生存期間(EFS:死亡、再発・増悪、2次がん発生をイベントとする)
副次評価項目:
生存期間、無増悪生存期間(PFS)、腫瘍残存例における奏効割合、キメラ抗体に対するヒト抗体(HACA)の産生割合、抗体依存性細胞傷害(ADCC)活性、G療法群/米国レジメン群それぞれのレジメンごとの有害事象プロファイル及び測定など
[解析計画]
*1 INRC(International Neuroblastoma Response Criteria:国際神経芽腫奏効基準)
*2 RECIST(Response Evaluation Criteria in Solid Tumors:固形がんの効果判定基準)
患者背景、FAS
FASのベースライン時における患者背景は以下の通りであった。
| 項目 | G療法群 (n=16) |
米国レジメン群 (n=19) |
|
|---|---|---|---|
| 年齢中央値、歳[範囲] | 3.0[2-5] | 4.0[2-8] | |
| 身長中央値、cm[範囲] | 96.30[77.1-112.5] | 95.00[79.0-124.6] | |
| 体重中央値、kg[範囲] | 14.25[8.5-20.1] | 13.30[9.7-23.3] | |
| 体表面積中央値、m²[範囲] | 0.635[0.43-0.79] | 0.590[0.46-0.89] | |
| 罹患期間中央値、日[範囲] | 303.0[190-361] | 292.0[203-392] | |
| 性別 | 男性 | 8(50.0%) | 11(57.9%) |
| 女性 | 8(50.0%) | 8(42.1%) | |
| PS(Lansky又はKarnofsky) | 100 | 16(100.0%) | 18(94.7%) |
| 60 | 0(0.0%) | 1(5.3%) | |
| 病理診断(INPC*1) | 1 | 1(6.3%) | 2(10.5%) |
| 2 | 14(87.5%) | 15(78.9%) | |
| 5 | 1(6.3%) | 0(0.0%) | |
| 不明 | 0(0.0%) | 2(10.5%) | |
| 初診時病期 (INSS分類) |
Stage 3 | 0(0.0%) | 1(5.3%) |
| Stage 4 | 16(100.0%) | 18(94.7%) | |
非表示部分は左右にスクロールして表示してください。
| 項目 | G療法群 (n=16) |
米国レジメン群 (n=19) |
|
|---|---|---|---|
| 原発巣:局所治療歴 | |||
| 手術 | あり | 15(93.8%) | 19(100.0%) |
| 放射線療法 | あり | 15(93.8%) | 18(94.7%) |
| 化学療法歴 | |||
| 寛解導入 化学療法*2 |
rapid COJEC | 0(0.0%) | 1(5.3%) |
| N7 | 0(0.0%) | 2(10.5%) | |
| その他 | 16(100.0%) | 17(89.5%) | |
| 大量療法 レジメン |
BU+Mel | 8(50.0%) | 10(52.6%) |
| CBDCA+ CPT-11+TMZ |
3(18.8%) | 2(10.5%) | |
| HiMEC | 4(25.0%) | 7(36.8%) | |
| BU+L-PAM +TBI |
1(6.3%) | 0(0.0%) | |
| 合併症 | あり | 16(100.0%) | 19(100.0%) |
| 心機能障害 | 2(12.5%) | 1(5.3%) | |
| 腎機能障害 | 1(6.3%) | 1(5.3%) | |
| 尿細管障害 | 1(6.3%) | 0(0.0%) | |
| 四肢麻痺 | 1(6.3%) | 0(0.0%) | |
| その他 | 16(100.0%) | 19(100.0%) | |
| IL-2使用歴 | なし | 16(100.0%) | 19(100.0%) |
非表示部分は左右にスクロールして表示してください。
1 INPC(国際神経芽腫病理学分類)
1:Neuroblastoma(Schwannian,stroma-poor),Undifferentiated(no obvious neuropil)
2:Neuroblastoma(Schwannian,stroma-poor),Poorly differentiated(ganglionic cell<5%)
5:Ganglioneuroblastoma,Nodular (composite Schwannian stroma-rich stroma-poor,GNB,nodular)
2 重複集計あり
INSS:国際神経芽腫病期分類
COJEC:シスプラチン/ビンクリスチン/カルボプラチン/エトポシド/シクロホスファミドによる療法、N7:シクロホスファミド/ドキソルビシン/ビンクリスチン/シスプラチン/エトポシドによる療法、BU:ブスルファン、Mel:メルファラン、CBDCA:カルボプラチン、CPT-11:イリノテカン、TMZ:テモゾロミド、HiMEC:メルファラン/エトポシド/カルボプラチンによる療法、L-PAM:メルファラン、TBI:全身照射
有効性
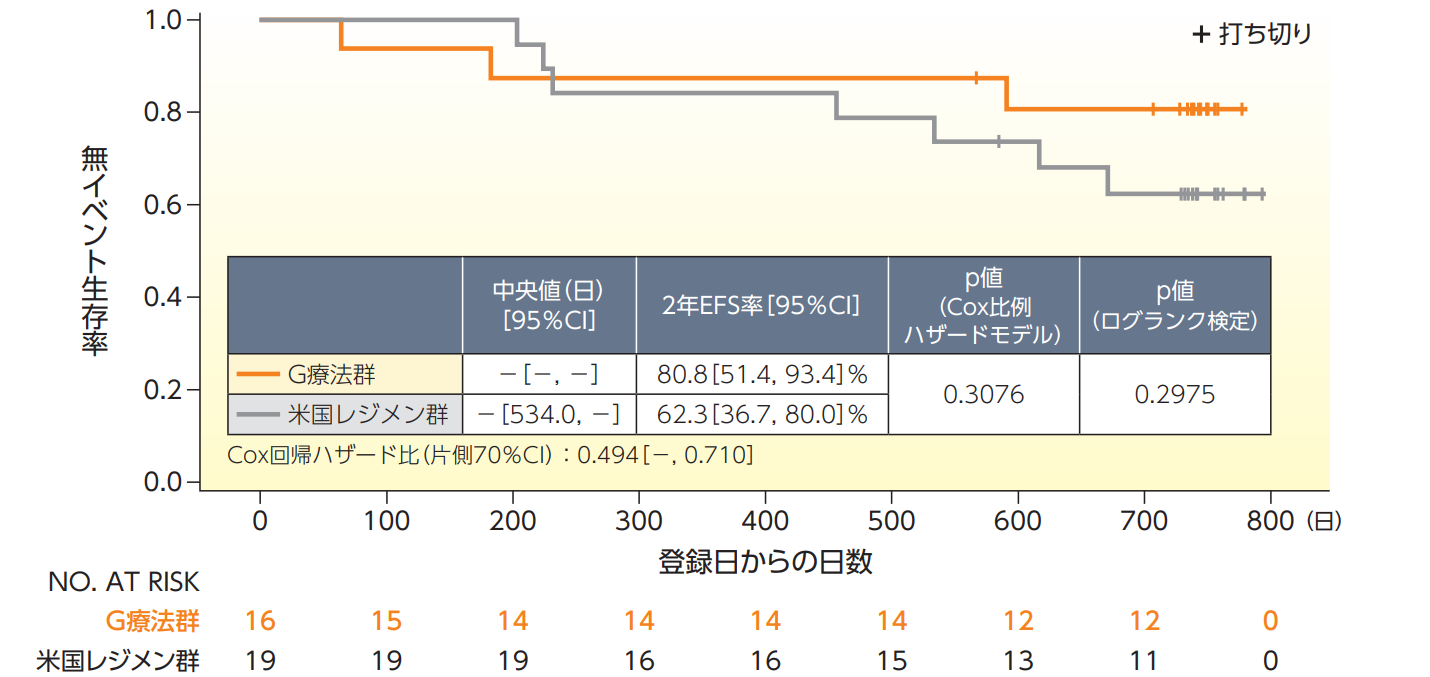
無イベント生存期間(EFS)【主要評価項目、FAS、登録日から2年間の追跡データ】
EFSのKaplan-Meier曲線は以下の通りであった。イベント発生数はG療法群が3例、米国レジメン群が7例であり、いずれのイベントも再発又は増悪によるものであった。2年EFS率におけるG療法群の米国レジメン群に対するハザード比は0.494(片側70%CIの上限:0.710)であり、片側70%CIの上限が1.854を下回ったことから、G療法群の米国レジメン群に対する非劣性が示された。
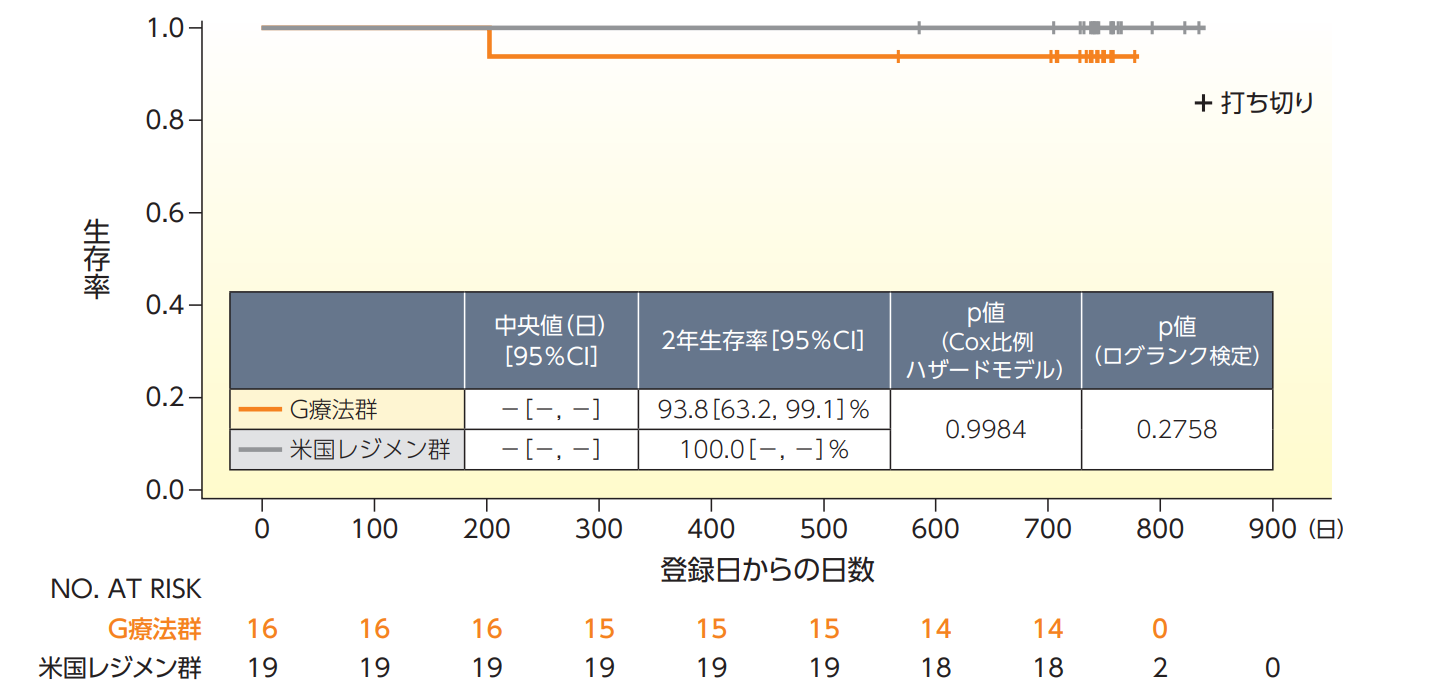
生存期間【副次評価項目、FAS、登録日から2年間の追跡データ】
生存期間のKaplan-Meier曲線は以下の通りであり、死亡例はG療法群の1例(最終投与後137日、原病によるもの)であった。
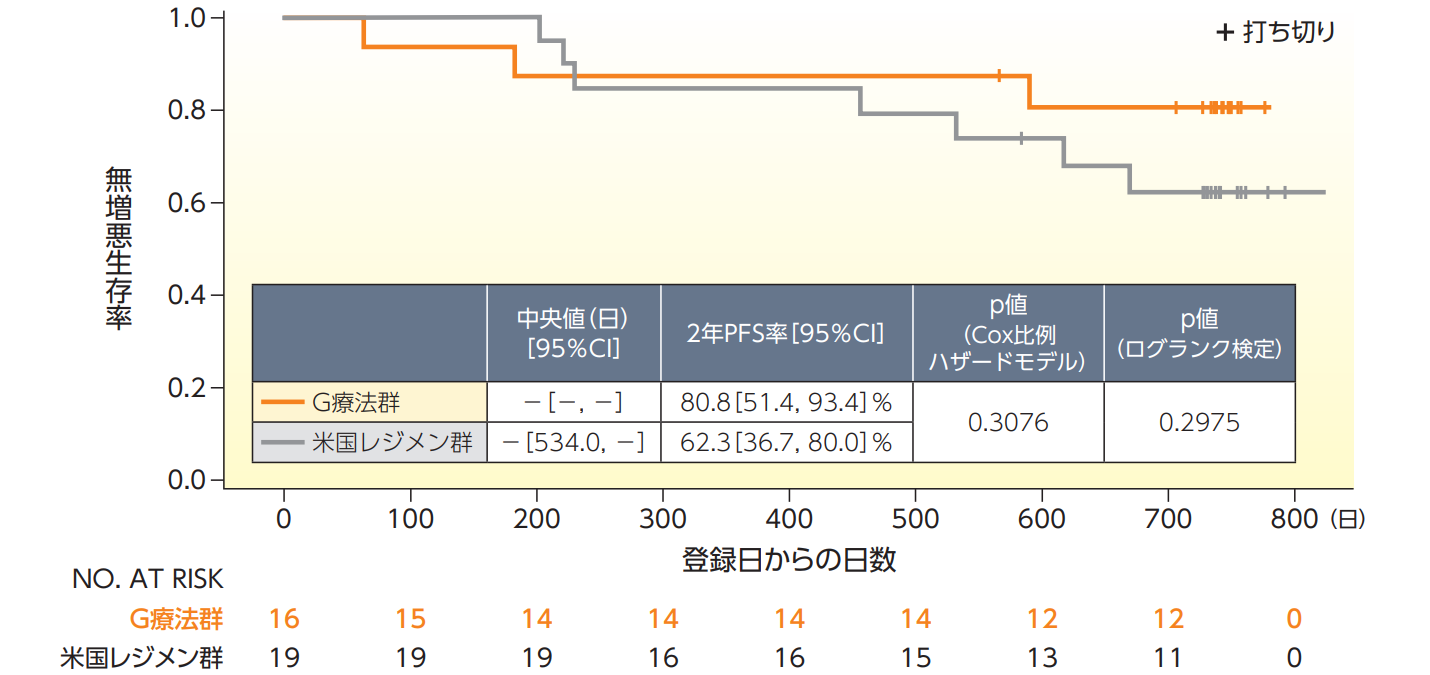
無増悪生存期間(PFS)【副次評価項目、FAS、登録日から2年間の追跡データ】
PFSのKaplan-Meier曲線は以下の通りであった。イベント発生数はG療法群が3例、米国レジメン群が7例であり、いずれのイベントも再発又は増悪によるものであった。
INRCに基づく奏効割合【副次評価項目、FAS、登録日から2年間の追跡データ】
腫瘍残存例(G療法群11例、米国レジメン群12例)のINRCに基づく効果判定は以下の通りであった。
| 評価時期 | 症例数 | 効果判定 | 奏効例数 | 奏効割合 (%) |
奏効割合の 両側95%CI |
|||||
| CR | VGPR | PR | MR | NR/SD | PD | |||||
| G療法群(n=16) | ||||||||||
| 腫瘍残存例 | 11 | |||||||||
| 2サイクル(IL-2レジメン) | 11 | 0 | 0 | 0 | 0 | 11 | 0 | 0 | 0.0 | 0.0-28.5 |
| 4サイクル(IL-2レジメン) | 10 | 0 | 0 | 0 | 0 | 10 | 0 | 0 | 0.0 | 0.0-30.8 |
| 6サイクル* | 10 | 0 | 0 | 0 | 0 | 10 | 0 | 0 | 0.0 | 0.0-30.8 |
| 完了・中止 | 11 | 0 | 0 | 0 | 0 | 9 | 2 | 0 | 0.0 | 0.0-28.5 |
| 米国レジメン群(n=19) | ||||||||||
| 腫瘍残存例 | 12 | |||||||||
| 2サイクル(IL-2レジメン) | 11 | 0 | 0 | 0 | 0 | 11 | 0 | 0 | 0.0 | 0.0-28.5 |
| 4サイクル(IL-2レジメン) | 11 | 0 | 0 | 0 | 1 | 10 | 0 | 0 | 0.0 | 0.0-28.5 |
| 6サイクル* | 11 | 0 | 0 | 0 | 2 | 9 | 0 | 0 | 0.0 | 0.0-28.5 |
| 完了・中止 | 12 | 0 | 0 | 0 | 2 | 8 | 2 | 0 | 0.0 | 0.0-26.5 |
*G療法群はIL-2レジメン、米国レジメン群はRAの単独レジメン
CR:完全奏効、VGPR:非常に良い部分奏効、PR:部分奏効、MR:混合奏効、NR:反応なし、SD:安定、PD:進行
非表示部分は左右にスクロールして表示してください。
RECISTに基づく奏効割合【副次評価項目、FAS、登録日から2年間の追跡データ】
腫瘍残存例(G療法群11例、米国レジメン群12例)のRECISTに基づく最良総合効果は以下の通りであった。
| 症例数 | 最良総合効果 | 奏効例数 | 奏効割合 (%) |
奏効割合の 両側95%CI |
||||||
| CR | PR | SD | PD | NE | ||||||
| G療法群(n=16) | ||||||||||
| 腫瘍残存例 | 11 | 0 | 0 | 0 | 2 | 9 | 0 | 0.0 | 0.0-28.5 | |
| 米国レジメン群(n=19) | ||||||||||
| 腫瘍残存例 | 12 | 0 | 0 | 2 | 2 | 8 | 0 | 0.0 | 0.0-26.5 | |
CR:完全奏効、PR:部分奏効、SD:安定、PD:進行、NE:評価不能
非表示部分は左右にスクロールして表示してください。
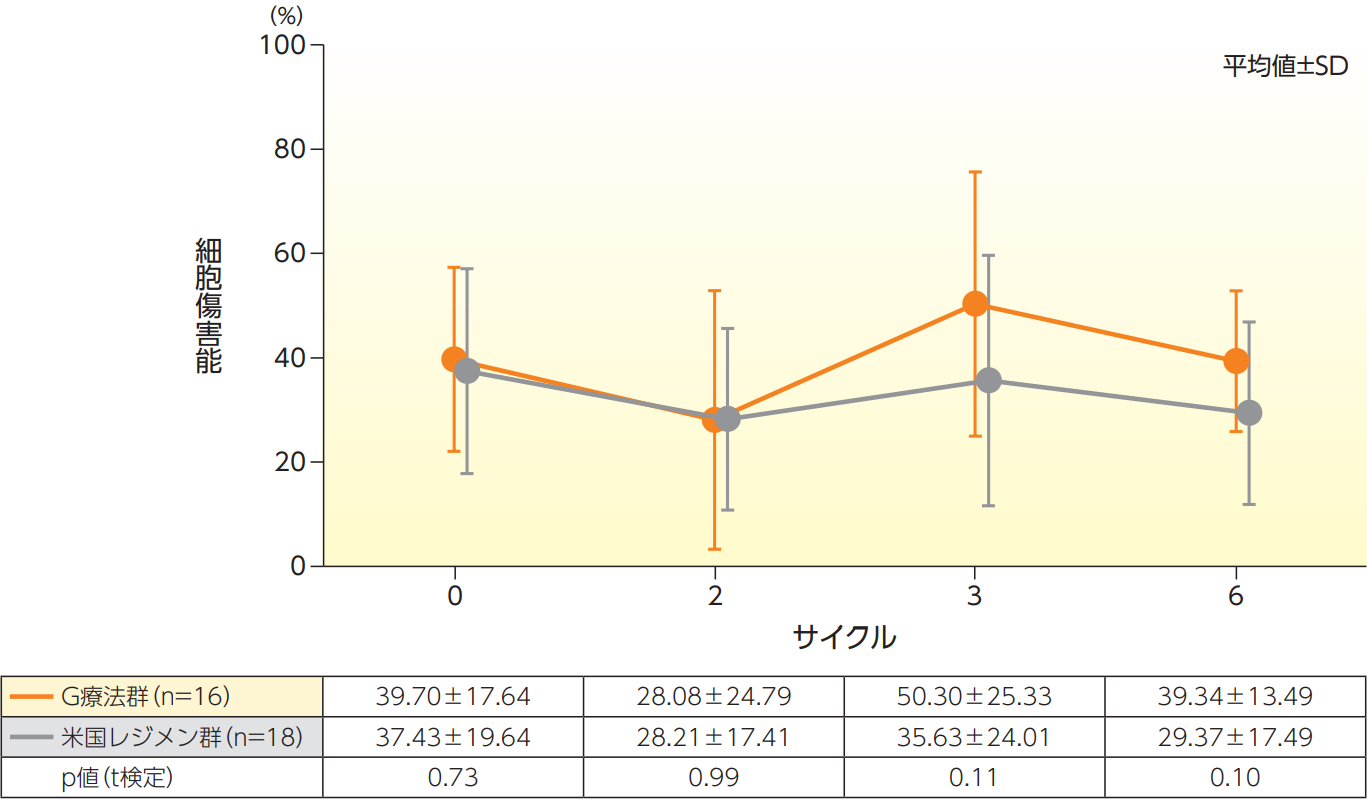
ADCC活性【副次評価項目】及び細胞表面抗原解析
E(エフェクター細胞)/T(標的細胞)=10の時の細胞傷害能を比較した結果は、以下の通りであった。また、各サイクル開始前の末梢血単核細胞(PBMC)中の各免疫細胞サブセットの割合(%)とADCC活性との相関を検索したが、NK細胞を含めた特定の免疫サブセットに依存することなく、効果を発揮していることが示された。
キメラ抗体に対するヒト抗体(HACA)の産生割合【副次評価項目】及び中和抗体の産生割合
HACA及び中和抗体の1、2、5サイクル終了時における産生割合は以下の通りであった。
| HACAの産生割合 (HACA陽性例/検査実施例) |
中和抗体の産生割合 (中和抗体陽性例/HACA陽性例) |
|
| G療法群 | ||
| 1サイクル終了後 | 6.7%(1/15例) | 0/1例 |
| 2サイクル終了後 | 18.8%(3/16例) | 2/3例 |
| 5サイクル終了後 | 6.7%(1/15例) | 1/1例 |
| 米国レジメン群 | ||
| 1サイクル終了後 | 33.3%(6/18例) | 1/6例 |
| 2サイクル終了後 | 27.8%(5/18例) | 4/5例 |
| 5サイクル終了後 | 29.4%(5/17例) | 5/5例 |
非表示部分は左右にスクロールして表示してください。
安全性
安全性の概要
有害事象はユニツキシンが1回以上投与された全ての患者(G療法群16例、米国レジメン群19例)に発現した。そのうち重篤な有害事象はG療法群4例(25.0%)、米国レジメン群1例(5.3%)であった。G療法群では医療機器関連感染(カテーテル関連感染)が2例、肺臓炎及び肺水腫が各1例発現し、そのうち肺臓炎及び肺水腫は副作用と判断された。米国レジメン群では口唇感染が1例発現し副作用と判断された。いずれの重篤な有害事象も転帰は回復であった。投与中止に至った有害事象はG療法群0例、米国レジメン群2例(10.5%)であった。死亡に至った有害事象は両群とも認められなかった。
<重篤な有害事象、投与中止及び死亡に至った有害事象の内訳>
| 安全性解析対象集団 | G療法群(n=16) | 米国レジメン群(n=19) |
|---|---|---|
| 重篤な有害事象 | カテーテル関連感染2例、肺臓炎1例、肺水腫1例 | 口唇感染1例 |
| 投与中止に至った有害事象 | 本試験では報告なし | 好中球数減少1例、血小板数減少1例 |
| 死亡に至った有害事象 | プロトコール治療中又は最終投与後30日以内に死亡した患者はいなかった (1例が原病により、最終投与後137日目に死亡) |
プロトコール治療中又は最終投与後30日以内に死亡した患者はいなかった |
MedDRA ver. 21.1
非表示部分は左右にスクロールして表示してください。
主な有害事象
(いずれかの群で全Grade50%以上の事象もしくは全Gradeの群間差が20%以上あった事象)
| 安全性解析対象集団 | G療法群(n=16) | 米国レジメン群(n=19) | ||
|---|---|---|---|---|
| 全Grad | Grade 3以上 | 全Grade | Grade 3以上 | |
| 全事象例数 | 16(100.0%) | 16(100.0%) | 19(100.0%) | 19(100.0%) |
| 発熱 | 16(100.0%) | 11(68.8%) | 19(100.0%) | 13(68.4%) |
| 低アルブミン血症 | 15(93.8%) | 0(0.0%) | 19(100.0%) | 0(0.0%) |
| アラニンアミノトランス フェラーゼ増加 |
14(87.5%) | 5(31.3%) | 15(78.9%) | 2(10.5%) |
| 好中球数減少 | 13(81.3%) | 11(68.8%) | 15(78.9%) | 12(63.2%) |
| 貧血 | 13(81.3%) | 8(50.0%) | 13(68.4%) | 7(36.8%) |
| γ-グルタミルトランス フェラーゼ増加 |
13(81.3%) | 2(12.5%) | 16(84.2%) | 6(31.6%) |
| 嘔吐 | 13(81.3%) | 0(0.0%) | 15(78.9%) | 0(0.0%) |
| アスパラギン酸アミノ トランスフェラーゼ増加 |
13(81.3%) | 0(0.0%) | 13(68.4%) | 1(5.3%) |
| 顔面浮腫 | 13(81.3%) | 0(0.0%) | 12(63.2%) | 0(0.0%) |
| 血小板数減少 | 12(75.0%) | 8(50.0%) | 14(73.7%) | 7(36.8%) |
| 便秘 | 12(75.0%) | 0(0.0%) | 11(57.9%) | 0(0.0%) |
| 食欲減退 | 11(68.8%) | 1(6.3%) | 12(63.2%) | 2(10.5%) |
| 倦怠感 | 11(68.8%) | 0(0.0%) | 14(73.7%) | 0(0.0%) |
| 疼痛 | 10(62.5%) | 1(6.3%) | 11(57.9%) | 3(15.8%) |
| 腹痛 | 10(62.5%) | 0(0.0%) | 11(57.9%) | 1(5.3%) |
| 下痢 | 9(56.3%) | 1(6.3%) | 11(57.9%) | 2(10.5%) |
| 血中尿素増加 | 8(50.0%) | 0(0.0%) | 7(36.8%) | 0(0.0%) |
| 咳嗽 | 8(50.0%) | 0(0.0%) | 6(31.6%) | 0(0.0%) |
| リンパ球数減少 | 7(43.8%) | 5(31.3%) | 4(21.1%) | 2(10.5%) |
| 体重増加 | 7(43.8%) | 0(0.0%) | 3(15.8%) | 0(0.0%) |
| 尿中白血球陽性 | 6(37.5%) | 0(0.0%) | 3(15.8%) | 0(0.0%) |
| 眼瞼浮腫 | 6(37.5%) | 0(0.0%) | 0(0.0%) | 0(0.0%) |
| 低ナトリウム血症 | 4(25.0%) | 0(0.0%) | 10(52.6%) | 1(5.3%) |
| 白血球数減少 | 3(18.8%) | 1(6.3%) | 8(42.1%) | 3(15.8%) |
| 皮膚乾燥 | 3(18.8%) | 0(0.0%) | 9(47.4%) | 0(0.0%) |
| 高カルシウム血症 | 1(6.3%) | 0(0.0%) | 7(36.8%) | 1(5.3%) |
| 斑状丘疹状皮疹 | 1(6.3%) | 0(0.0%) | 5(26.3%) | 0(0.0%) |
MedDRA ver. 21.1、CTCAE ver. 4.0
非表示部分は左右にスクロールして表示してください。

