臨床成績
国内第Ⅰ/Ⅱa相試験(GD2-PⅠ試験)、国内第Ⅱb相試験(GD2-PⅡ試験)及び海外第Ⅲ相試験(DIV-NB-301試験)は一部国内での承認内容と異なる成績が含まれていますが、承認時評価資料のため掲載します。
国内第Ⅰ/Ⅱa相試験(GD2-PⅠ試験)
(非無作為化、非盲検、多施設共同試験、2013-2015年)
承認時評価資料:国内第Ⅰ/Ⅱa相試験(GD2-PⅠ試験)
[目 的]
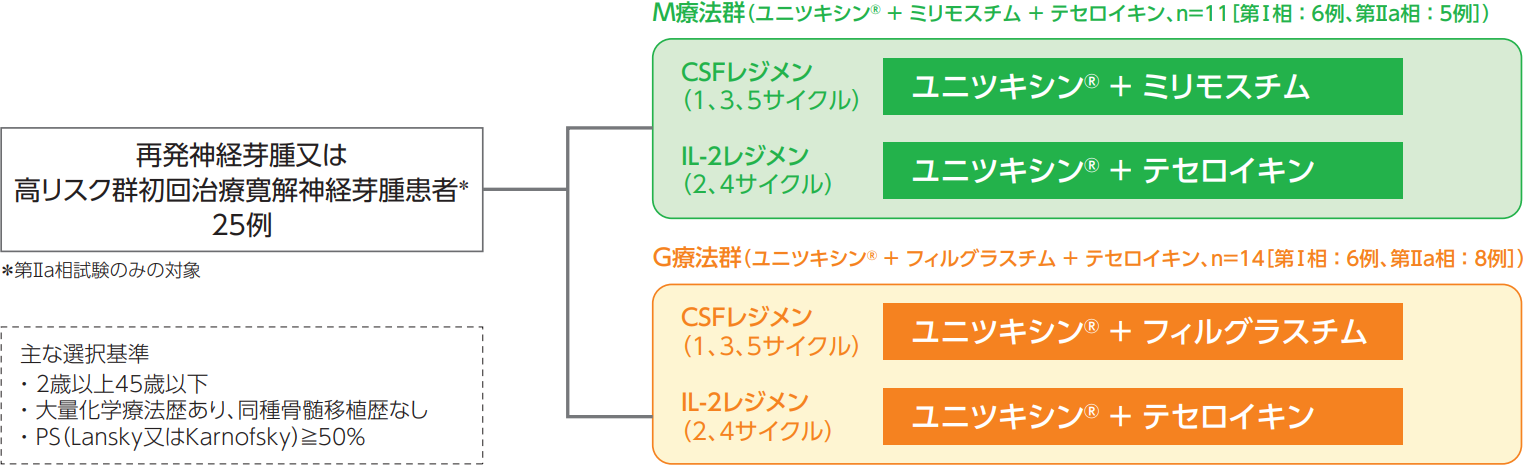
再発神経芽腫又は高リスク群初回治療寛解神経芽腫患者を対象として、M療法群(ユニツキシン、ミリモスチム、テセロイキンを併用[DIN/MIL/TEC群])及びG療法群(ユニツキシン、フィルグラスチム、テセロイキンを併用[DIN/FIL/TEC群])の用量探索及びレジメンの実行可能性の確認を行う。
[対 象]
再発神経芽腫及び高リスク群初回治療寛解神経芽腫患者25例(full analysis set[FAS])
・第Ⅰ相試験:再発神経芽腫患者12例(M療法群:6例、G療法群:6例)
・第Ⅱa相試験:再発神経芽腫及び高リスク群初回治療寛解神経芽腫患者13例(M療法群:5例、G療法群:8例)
[方 法]
第Ⅰ相試験:
以下の開始用量レベル及びレベル変更方法に従って、CSFレジメン、IL-2レジメンの各1サイクル目の用量制限毒性(DLT)の有無に基づき、各薬剤の推奨用量(RD)を決定した。
<試験デザイン>
●CSFレジメン
| 薬剤 | M療法群 | G療法群 | ||
| ユニツキシン | ミリモスチム | ユニツキシン | フィルグラスチム | |
| 開始用量レベル | レベル 1 | レベル 1 | レベル 1 | レベル 1 |
| レベル変更方法 | 3+3減量デザイン | 3+3減量デザイン | ― | 3+3減量デザイン |
非表示部分は左右にスクロールして表示してください。
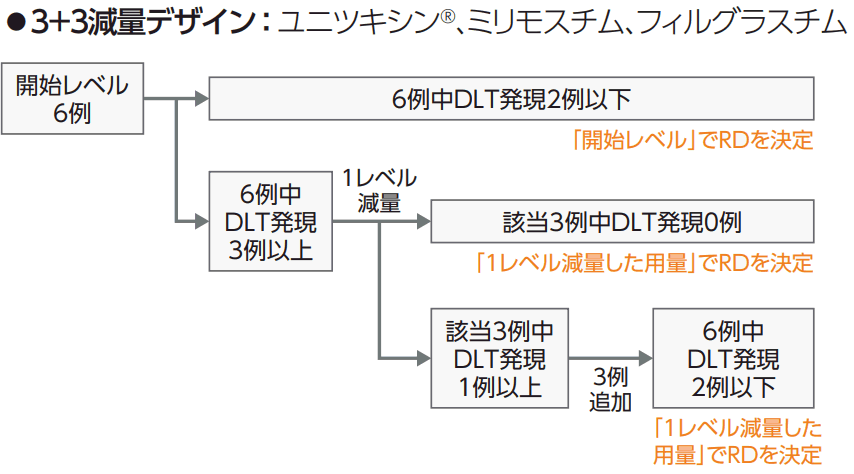
●IL-2レジメン
| 薬剤 | ユニツキシン | テセロイキン |
| 開始用量レベル | レベル 1 | レベル 0 |
| レベル変更方法 | 3+3減量デザイン | 3+3増量デザイン |
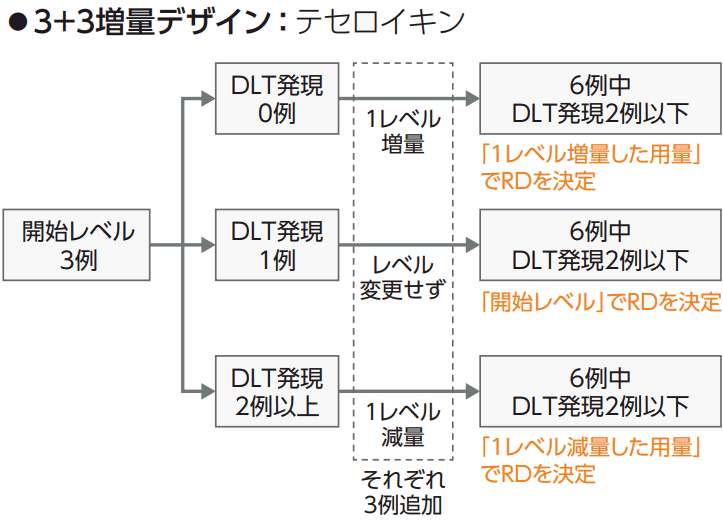
<用量及び投与方法>
| 薬剤 | レベル -1 | レベル 0 | レベル 1 |
|---|---|---|---|
| ユニツキシン*1 | ― | 14mg/m²/10~20時間 点滴静注 | 17.5mg/m²/10~20時間 点滴静注 |
| ミリモスチム*2 | ― | 300万単位/m²/2時間 点滴静注 | 600万単位/m²/2時間 点滴静注 |
| フィルグラスチム*3 | ― | 2μg/kg 皮下注 | 5μg/kg 皮下注 |
| テセロイキン(1週目)*4 | 55万単位/m²/24時間 点滴静注 | 75万単位/m²/24時間 点滴静注 | 100万単位/m²/24時間 点滴静注 |
| テセロイキン(2週目)*5 | 75万単位/m²/24時間 点滴静注 | 100万単位/m²/24時間 点滴静注 | 150万単位/m²/24時間 点滴静注 |
1 CSFレジメンでは、Day4~Day7に、ユニツキシンを所定の体表面積あたりの投与量で10~20時間かけて点滴投与(CSF投与後に1時間以上空けて実施)。
IL-2レジメンでは、Day8~Day11までの4日間、ユニツキシンを所定の体表面積あたりの投与量で10~20時間かけて点滴投与(テセロイキン投与開始後に実施)。
2 Day1~Day14に、ミリモスチムを所定の体表面積あたりの投与量で2時間以上かけて点滴投与(ユニツキシン投与前に実施)。
3 Day1~Day14に、フィルグラスチムを所定の体重あたりの投与量で皮下注(ユニツキシン投与前に実施)。
4 Day1~Day4に、テセロイキンを所定の体表面積あたりの投与量で24時間かけて点滴投与。
5 Day8~Day11に、テセロイキンを所定の体表面積あたりの投与量で24時間かけて点滴投与(ユニツキシン投与の2時間前程度を目安)。
非表示部分は左右にスクロールして表示してください。
※本試験のM療法群で使用されているミリモスチムは小児の神経芽腫に対しては国内未承認の薬剤です。
※国内におけるユニツキシン点滴静注17.5mg/5mLの承認された用法及び用量は「フィルグラスチム(遺伝子組換え)及びテセロイキン(遺伝子組換え)との併用において、通常、ジヌツキシマブ(遺伝子組換え)として1日1回17.5mg/m2(体表面積)を10~20時間かけて点滴静注する。28日間を1サイクルとし、1、3、5サイクルは4~7日目、2、4、6サイクルは8~11日目に投与する。」です。
第Ⅱa相試験:
第Ⅰ相試験で確認した用法及び用量で、M療法群及びG療法群の反復投与を行った。なお、第Ⅰ相試験で受けた患者の評価も含めるため、本試験は追加コホートとして実施した。
<試験デザイン>
投薬期間と休薬期間を合わせて28日間を1サイクルとし、計5サイクル実施。
なお、患者の希望により7サイクル(6サイクル目:IL-2レジメン、7サイクル目 : CSFレジメン)まで実施可能とした。
※なお、臨床試験においては、ユニツキシン投与は支持療法併用下で行われた(支持療法の詳細はGD2-PⅡ試験等を参照)。
[評価項目]
主要評価項目:
第Ⅰ相試験:M療法群・G療法群でのCSFレジメン及びIL-2レジメン1サイクル目でのDLTの有無
第Ⅱa相試験:M療法群・G療法群のプロトコール治療の完遂
副次評価項目:
M療法群・G療法群それぞれのレジメンごとの有害事象プロファイル、奏効割合、全生存期間(OS)、無病生存期間(DFS)、無増悪生存期間(PFS)など
[解析計画]
DLT発現については、DLT発現の有無及び判定不能の頻度とその割合を算出した。プロトコール治療完遂については、プロトコール治療の完了及び中止の頻度とその割合を算出した。有効性と安全性の対象はFASとした。奏効割合は、INRC*1及びRECIST*2でそれぞれ評価を行った。OS、DFS、PFSの生存曲線は Kaplan-Meier法により推定した。
*1 INRC(International Neuroblastoma Response Criteria:国際神経芽腫奏効基準)
*2 RECIST(Response Evaluation Criteria in Solid Tumors:固形がんの効果判定基準)
患者背景、FAS
FASのベースライン時における患者背景は以下の通りであった。
| 項目 | 第Ⅰ/Ⅱa相 | ||
| M療法群(n=11) | G療法群(n=14) | ||
| 年齢中央値、歳[範囲] | 6.0 [2-14] | 3.5 [2-10] | |
| 身長中央値、cm[範囲] | 111.00 [83.0-153.0] | 96.40 [78.5-126.1] | |
| 体重中央値、kg[範囲] | 17.30 [10.8-36.5] | 14.05 [10.0-28.3] | |
| 体表面積中央値、m²[範囲] | 0.730 [0.50-1.25] | 0.620 [0.48-1.00] | |
| 性別 | 男性 | 6 (54.5%) | 7 (50.0%) |
| 女性 | 5 (45.5%) | 7 (50.0%) | |
| PS(Lansky又は Karnofsky) |
100 | 11 (100.0%) | 13 (92.9%) |
| 90 | 0 (0.0%) | 1 (7.1%) | |
| 病理診断 (INPC*) |
1 | 1 (9.1%) | 0 (0.0%) |
| 2 | 6 (54.5%) | 11 (78.6%) | |
| 3 | 1 (9.1%) | 0 (0.0%) | |
| 4 | 1 (9.1%) | 0 (0.0%) | |
| 5 | 1 (9.1%) | 0 (0.0%) | |
| 6 | 1 (9.1%) | 0 (0.0%) | |
| 9 | 0 (0.0%) | 3 (21.4%) | |
| 初診時病期 (INSS分類) |
Stage 3 | 2 (18.2%) | 3 (21.4%) |
| Stage 4 | 9 (81.8%) | 11 (78.6%) | |
| 合併症 | 心機能障害 | 2 (18.2%) | 0 (0.0%) |
| 腎機能障害 | 1 (9.1%) | 1 (7.1%) | |
| 尿細管障害 | 0 (0.0%) | 1 (7.1%) | |
| 呼吸器障害 | 1 (9.1%) | 2 (14.3%) | |
| その他 | 9 (81.8%) | 11 (78.6%) | |
| 治療歴 | |||
| 手術 | あり | 9 (81.8%) | 8 (57.1%) |
| 放射線療法 | あり | 10 (90.9%) | 12 (85.7%) |
| 化学療法との併用 | あり | 2 (18.2%) | 5 (35.7%) |
| 化学療法歴 | |||
| 使用薬剤 | ドキソルビシン/ ピラルビシン |
10 (90.9%) | 14 (100.0%) |
| イホスファミド | 6 (54.5%) | 5 (35.7%) | |
| イリノテカン | 3 (27.3%) | 8 (57.1%) | |
| イギテカン | 9 (81.8%) | 6 (42.9%) | |
| 大量療法レジメン | あり | 11 (100.0%) | 14 (100.0%) |
| その他の治療歴 | あり | 4 (36.4%) | 9 (64.3%) |
| IL-2製剤使用歴 | なし | 11 (100.0%) | 14 (100.0%) |
| 抗GD2抗体製剤 使用歴 |
なし | 11 (100.0%) | 14 (100.0%) |
INPC(国際神経芽腫病理学分類)
1:Neuroblastoma(Schwannian,stroma-poor),Undifferentiated(no obvious neuropil)
2:Neuroblastoma(Schwannian,stroma-poor),Poorly differentiated(ganglionic cell<5%)
3:Neuroblastoma(Schwannian,stroma-poor),Differentiating(5%<ganglionic cell)
4:Ganglioneuroblastoma,Intermixed(Schwannian stroma-rich, GNB stroma-rich)
5:Ganglioneuroblastoma,Nodular(composite Schwannian stroma-rich stroma-poor,GNB,nodular)
6:unfavourable
9:その他
INSS:国際神経芽腫病期分類
非表示部分は左右にスクロールして表示してください。
安全性
用量制限毒性(DLT)の発現状況【主要評価項目、第Ⅰ相】
1サイクルに実施したCSFレジメンによる治療では、M療法群、G療法群ともにDLTの発現は認められなかった。
2サイクルのIL-2レジメンでは、12例中2例(16.7%)にDLTが発現し、両例ともM療法群であった。その内訳は、Grade 4の血小板数減少(テセロイキン特異的DLT)が1例、Grade 3の低カリウム血症(テセロイキン非特異的DLT)が1例であった。
| サイクル/療法 | M療法群 | G療法群 |
|---|---|---|
| 1サイクル(CSFレジメン) | 0/6例 | 0/6例 |
| 2サイクル(IL-2レジメン) | 2/6例 | 0/6例 |
非表示部分は左右にスクロールして表示してください。
第Ⅰ相パートにおける用量探索の結果、M療法群では、ユニツキシン、ミリモスチムともに開始用量の レベル1(17.5mg/m2、600万単位/m2)を、G療法群では、ユニツキシン、フィルグラスチムともに開始用量のレベル1(17.5mg/m2 、5μg/kg)を推奨用量(RD)に決定した。また、IL-2レジメンにおいては、ユニツキシンは開始用量のレベル1(17.5mg/m2)を、テセロイキンは増量コホートの検討なく、開始用量のレベル0(75万単位/m2[1週目]、100万単位/m2 [2週目])をRDに決定した。
プロトコール治療の完遂状況【主要評価項目、FAS、第Ⅱa相】
全5サイクルにおけるプロトコール治療の完遂状況は以下の通りであった。
| 項目 | 第Ⅰ相 | 第Ⅱa相 | 第Ⅰ相+第Ⅱa相 | ||||
| M療法群 (n=6) |
G療法群 (n=6) |
M療法群 (n=5) |
G療法群 (n=8) |
M療法群 (n=11) |
G療法群 (n=14) |
||
| 全5サイクル の完遂 |
プロトコール治療完了 | 5 | 5 | 4 | 6 | 9(81.8%) | 11(78.6%) |
| プロトコール治療中止 | 1 | 1 | 1 | 2 | 2(18.2%) | 3(21.4%) | |
非表示部分は左右にスクロールして表示してください。
プロトコール治療中止は、第Ⅰ相試験においてM療法群1例(Grade 3のALT増加)、G療法群1例(原病増悪)であり、第Ⅱa相試験においてはM療法群1例(Grade 4の白血球数減少、好中球数減少及び血小板数減少)、G療法群2例(Grade 4のALT増加が1例、原病増悪及び膵炎が1例)であった。
なお、M療法群では7例が、G療法群では8例が7サイクルまで治療継続し、完了した。
安全性の概要
有害事象は全ての患者(M療法群11例、G療法群14例)に発現した。そのうち重篤な有害事象はM療法群4例(36.3%)、G療法群7例(50.0%)であった。M療法群では医療機器関連感染(カテーテル関連感染)が3例、発熱及び視神経萎縮が1例発現し、G療法群では医療機器関連感染(カテーテル関連感染)が4例、肺感染、膵炎及びアラニンアミノトランスフェラーゼ増加が1例発現した。投与中止に至った有害事象はM療法群2例(18.2%)、G療法群2例(14.3%)であった。死亡に至った有害事象は両群とも認められず、転帰が「後遺症あり」と判定された事象も認められなかった。
<重篤な有害事象、投与中止及び死亡に至った有害事象の内訳>
| 安全性解析対象集団 | M療法群(n=11) | G療法群(n=14) |
| 重篤な有害事象 | カテーテル関連感染3例、発熱1例、視神経萎縮1例 (1例はカテーテル関連感染及び発熱を重複) |
カテーテル関連感染4例、肺感染1例、膵炎1例、 アラニンアミノトランスフェラーゼ増加1例 |
| 投与中止に至った有害事象 | 2例 | 2例 |
| 第Ⅰ相試験 :アラニンアミノトランスフェラーゼ増加1例、原病増悪1例 第Ⅱa相試験:白血球数減少1例、好中球数減少1例、血小板数減少1例、 膵炎1例、アラニンアミノトランスフェラーゼ増加1例(重複例あり) |
||
| 死亡に至った有害事象 | 本試験では報告なし | 本試験では報告なし |
MedDRA ver.18.1
非表示部分は左右にスクロールして表示してください。
主な有害事象
(いずれかの群で全Grade50%以上の事象もしくは全Gradeの群間差が20%以上あった事象)
| 安全性解析対象集団 | M療法群(n=11) | G療法群(n=14) | ||
| 全Grade | Grade 3以上 | 全Grade | Grade 3以上 | |
| 全事象例数 | 11 (100.0%) | 11 (100.0%) | 14 (100.0%) | 14 (100.0%) |
| 好中球数減少 | 11 (100.0%) | 10 (90.9%) | 12 (85.7%) | 8 (57.1%) |
| 発熱 | 11 (100.0%) | 5 (45.5%) | 13 (92.9%) | 7 (50.0%) |
| 貧血 | 11 (100.0%) | 5 (45.5%) | 10 (71.4%) | 4 (28.6%) |
| 疼痛 | 11 (100.0%) | 0 (0.0%) | 14 (100.0%) | 1 (7.1%) |
| 低アルブミン血症 | 11 (100.0%) | 0 (0.0%) | 14 (100.0%) | 0 (0.0%) |
| 血小板数減少 | 10 (90.9%) | 6 (54.5%) | 11 (78.6%) | 7 (50.0%) |
| アラニンアミノトランス フェラーゼ増加 |
10 (90.9%) | 4 (36.4%) | 13 (92.9%) | 6 (42.9%) |
| アスパラギン酸アミノ トランスフェラーゼ増加 |
10 (90.9%) | 2 (18.2%) | 14 (100.0%) | 4 (28.6%) |
| 低ナトリウム血症 | 10 (90.9%) | 0 (0.0%) | 9 (64.3%) | 1 (7.1%) |
| γ-グルタミル トランスフェラーゼ増加 |
9 (81.8%) | 3 (27.3%) | 11 (78.6%) | 5 (35.7%) |
| 低カリウム血症 | 9 (81.8%) | 1 (9.1%) | 9 (64.3%) | 2 (14.3%) |
| 嘔吐 | 9 (81.8%) | 0 (0.0%) | 11 (78.6%) | 1 (7.1%) |
| 便秘 | 9 (81.8%) | 0 (0.0%) | 11 (78.6%) | 0 (0.0%) |
| 高血圧 | 8 (72.7%) | 1 (9.1%) | 6 (42.9%) | 0 (0.0%) |
| 倦怠感 | 8 (72.7%) | 0 (0.0%) | 12 (85.7%) | 0 (0.0%) |
| そう痒症 | 8 (72.7%) | 0 (0.0%) | 7 (50.0%) | 0 (0.0%) |
| 白血球数減少 | 7 (63.6%) | 3 (27.3%) | 8 (57.1%) | 2 (14.3%) |
| 食欲減退 | 7 (63.6%) | 0 (0.0%) | 10 (71.4%) | 0 (0.0%) |
| 低リン酸血症 | 7 (63.6%) | 0 (0.0%) | 9 (64.3%) | 0 (0.0%) |
| 血中クレアチニン増加 | 6 (54.5%) | 0 (0.0%) | 5 (35.7%) | 0 (0.0%) |
| 下痢 | 5 (45.5%) | 0 (0.0%) | 10 (71.4%) | 1 (7.1%) |
| 顔面浮腫 | 5 (45.5%) | 0 (0.0%) | 10 (71.4%) | 0 (0.0%) |
| 咳嗽 | 5 (45.5%) | 0 (0.0%) | 9 (64.3%) | 1 (7.1%) |
| 悪心 | 5 (45.5%) | 0 (0.0%) | 8 (57.1%) | 0 (0.0%) |
| 体重減少 | 4 (36.4%) | 0 (0.0%) | 8 (57.1%) | 0 (0.0%) |
| 上気道感染 | 3 (27.3%) | 0 (0.0%) | 0 (0.0%) | 0 (0.0%) |
| 低酸素症 | 2 (18.2%) | 1 (9.1%) | 9 (64.3%) | 0 (0.0%) |
| 低血圧 | 1 (9.1%) | 0 (0.0%) | 6 (42.9%) | 0 (0.0%) |
| 尿閉 | 1 (9.1%) | 0 (0.0%) | 5 (35.7%) | 0 (0.0%) |
| 過敏症 | 0 (0.0%) | 0 (0.0%) | 4 (28.6%) | 0 (0.0%) |
| 発疹 | 0 (0.0%) | 0 (0.0%) | 3 (21.4%) | 0 (0.0%) |
| 皮膚乾燥 | 0 (0.0%) | 0 (0.0%) | 3 (21.4%) | 0 (0.0%) |
MedDRA ver. 18.1、CTCAE ver. 4.0
非表示部分は左右にスクロールして表示してください。
有効性
INRCに基づく奏効割合【副次評価項目、FAS】
治療の完了及び中止時の新病変出現の有無及び効果判定結果は以下の通りであった。
| 項目 | M療法群 | G療法群 | |
| 新病変出現の有無 | n=9 | n=13 | |
| なし | 9 | 12 | |
| あり | 0 | 1 | |
| 効果判定 | n=8 | n=10 | |
| CR | 1 | 1 | |
| VGPR | 0 | 0 | |
| PR | 1 | 2 | |
| MR | 0 | 0 | |
| NR/SD | 5 | 5 | |
| PD | 1 | 2 | |
CR:完全奏効、VGPR:非常に良い部分奏効、PR:部分奏効、MR:混合奏効、NR:反応なし、SD:安定、PD:進行
非表示部分は左右にスクロールして表示してください。
RECISTに基づく奏効割合【副次評価項目、FAS】
最終サイクルにおける最良総合効果は以下の通りであった。
| 項目 | M療法群 (n=9) |
G療法群 (n=10) |
|
| 最良総合効果 | CR | 0 | 1 |
| PR | 1 | 0 | |
| SD | 8 | 8 | |
| PD | 0 | 1 | |
| NE | 0 | 0 | |
NE:評価不能
非表示部分は左右にスクロールして表示してください。
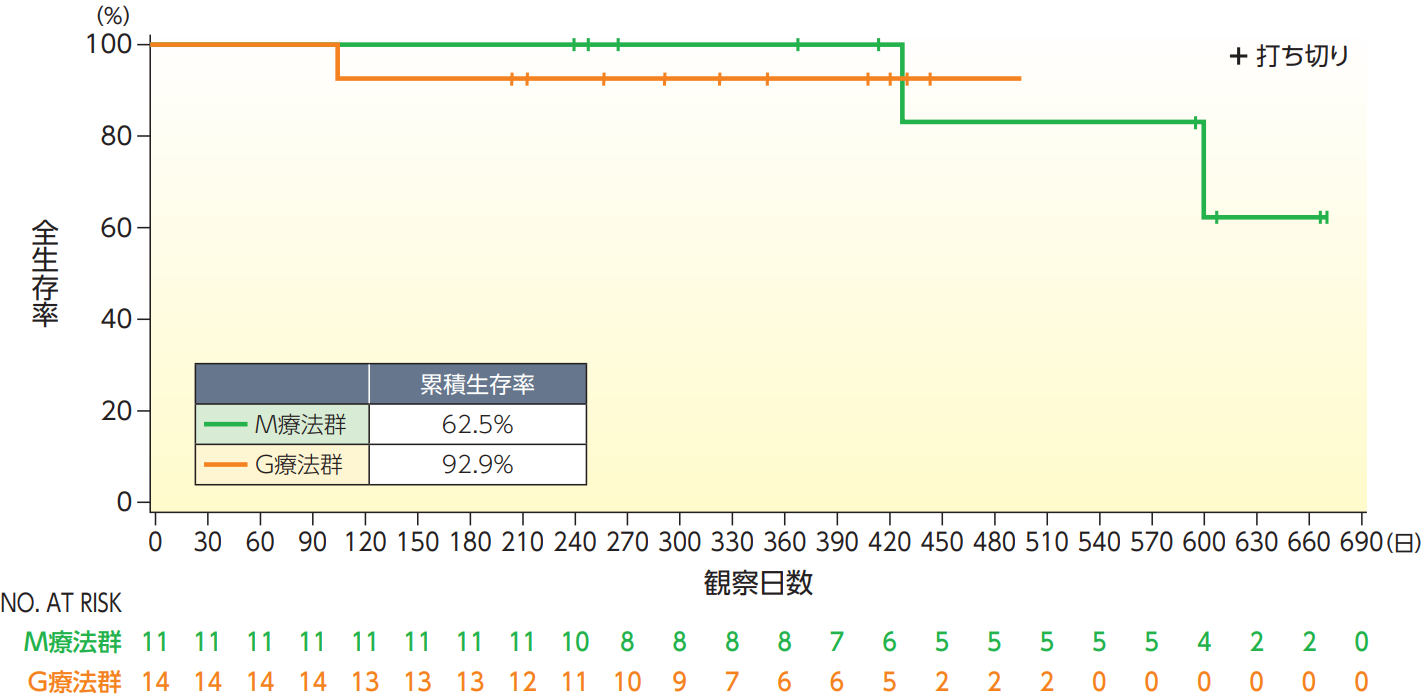
全生存期間(OS)【副次評価項目】
OSのKaplan-Meier曲線は以下の通りであり、死亡例はM療法群2例、G療法群1例であった。
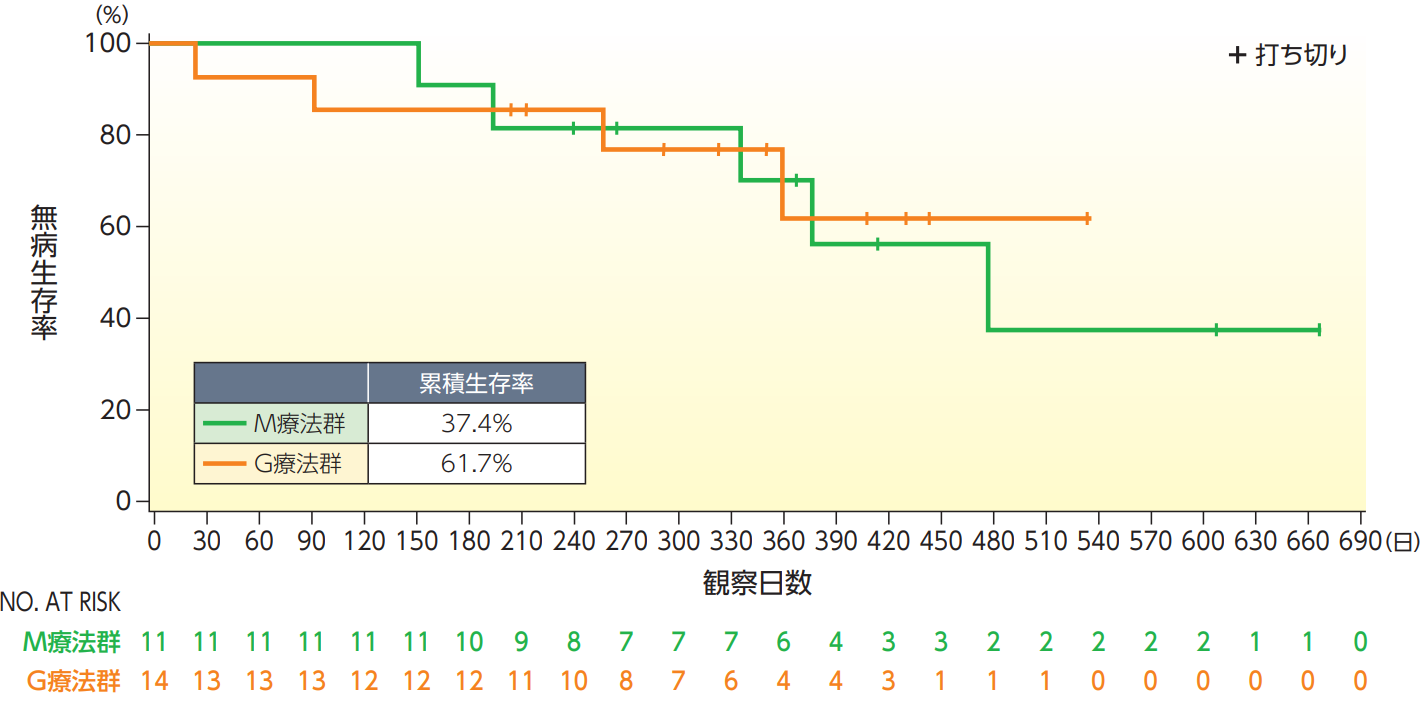
無病生存期間(DFS)【副次評価項目】
DFSのKaplan-Meier曲線は以下の通りであった。
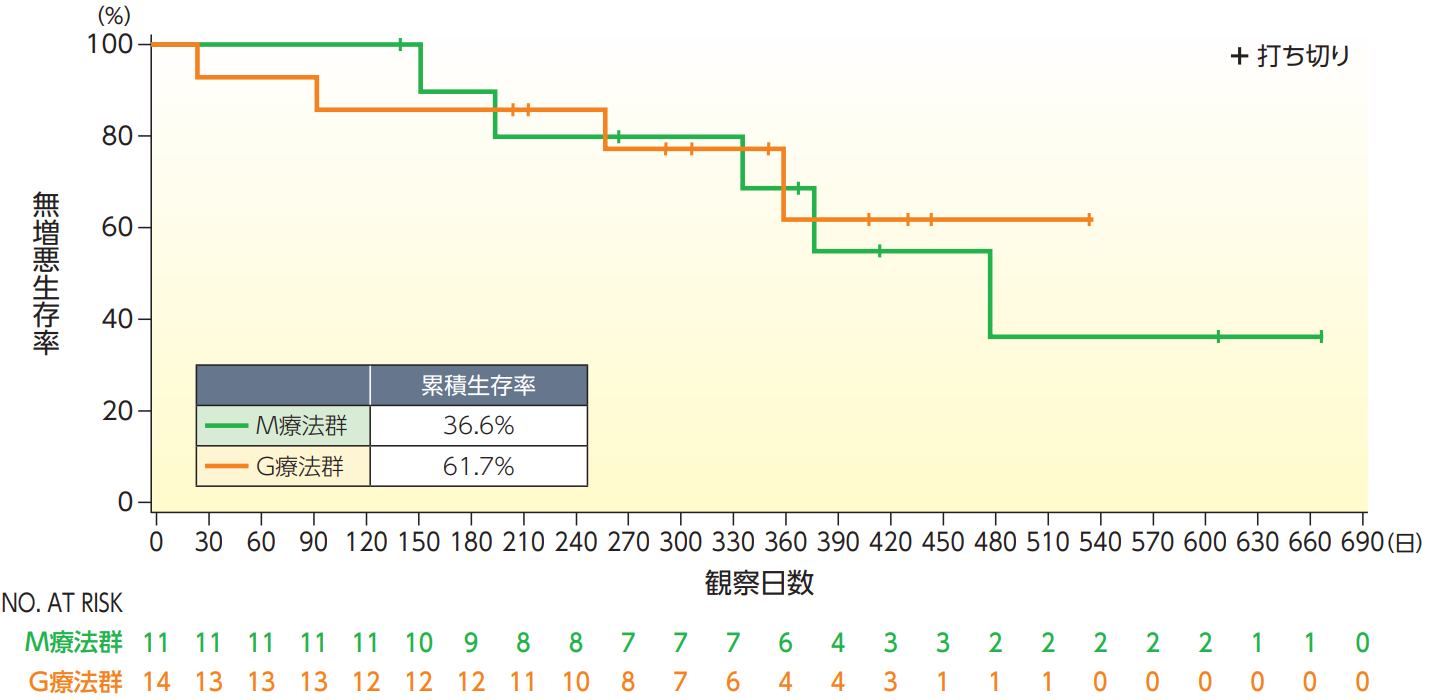
無増悪生存期間(PFS)【副次評価項目】
PFSのKaplan-Meier曲線は以下の通りであり、PFSの平均値(±SD)はM療法群で386.1±42.8日、G療法群で307.2±33.1日であった。