使用方法
ユニツキシンの使用にあたってのご注意
(1)患者選択における注意点
1)効能又は効果
大量化学療法後の神経芽腫
(効能又は効果に関連する注意)
臨床試験に組み入れられた患者のリスク群、腫瘍の状況等について添付文章「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者を選択してください。
2)禁忌
本剤の成分に対し過敏症の既往歴のある患者
3)特定の背景を有する患者に関する注意
生殖能を有する者
妊娠可能な女性に対しては、本剤の投与中及び投与終了後一定期間*は適切な避妊を行うよう指導してください。
妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与してください。 本剤を用いた生殖発生毒性試験は実施されていません。本剤の標的であるGD2は、ヒト胎児において脳、神経幹細胞及び骨髄間葉系幹細胞に発現が認められており、本剤の作用機序から、本剤が投与された場合、胎児に悪影響を及ぼす可能性があります。
授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討してください。本剤のヒト母乳中への移行に関するデータはありませんが、ヒトIgG抗体は、ヒト乳汁中に排出されることが知られています。
*: 非遺伝毒性医薬品については、FDAガイダンス(「抗がん剤の生殖毒性試験とラベル表示に関する推奨事項」)において、最終投与後、半減期の5倍の避妊期間が推奨されている。本剤の米国添付文書では、海外第Ⅱ相試験(DIV-NB-201試験)における本剤の最終相の半減期が10日(米国添付文書12.3 Pharmacokinetics)であることを踏まえ、最終投与終了後2箇月間は適切な避妊を行う旨が記載されている。
(2)患者・その家族の方への説明と指導
ユニツキシンを投与される患者又はその家族の方に対しては、投与前に、ユニツキシンの効能又は効果、発現する可能性のある副作用とその予防・対処方法等について十分に説明し、同意を得てから投与を開始してください。
ユニツキシンハンドブック
説明に際しては、以下の資材等をご活用ください。
ユニツキシンによる治療期間中に異常を感じた場合には、すぐに医療機関に連絡するよう指導してください。

(3)重要な基本的注意
毛細血管漏出症候群があらわれることがあるので、本剤の投与中は定期的に血圧、体液バランス、尿比重、体重、血清アルブミン値の測定を行う等、患者の状態を十分に観察してください。
低血圧があらわれることがあるので、本剤の投与中は頻回に血圧測定を行う等、患者の状態を十分に観察してください。
infusion reaction、毛細血管漏出症候群、低血圧等があらわれることがあるので、本剤の投与前には、必要な静脈内輸液を行ってください。
骨髄抑制があらわれることがあるので、本剤の投与中は定期的に血液検査を行い、患者の状態を十分に観察してください。
電解質異常の発現が報告されているので、本剤の投与中は定期的に血清中電解質検査(カリウム、ナトリウム、マグネシウム等)を行ってください。
眼障害があらわれることがあり、失明に至った例も報告されているので、本剤の投与中は定期的に眼科検査を行い、患者の状態を十分に観察してください。
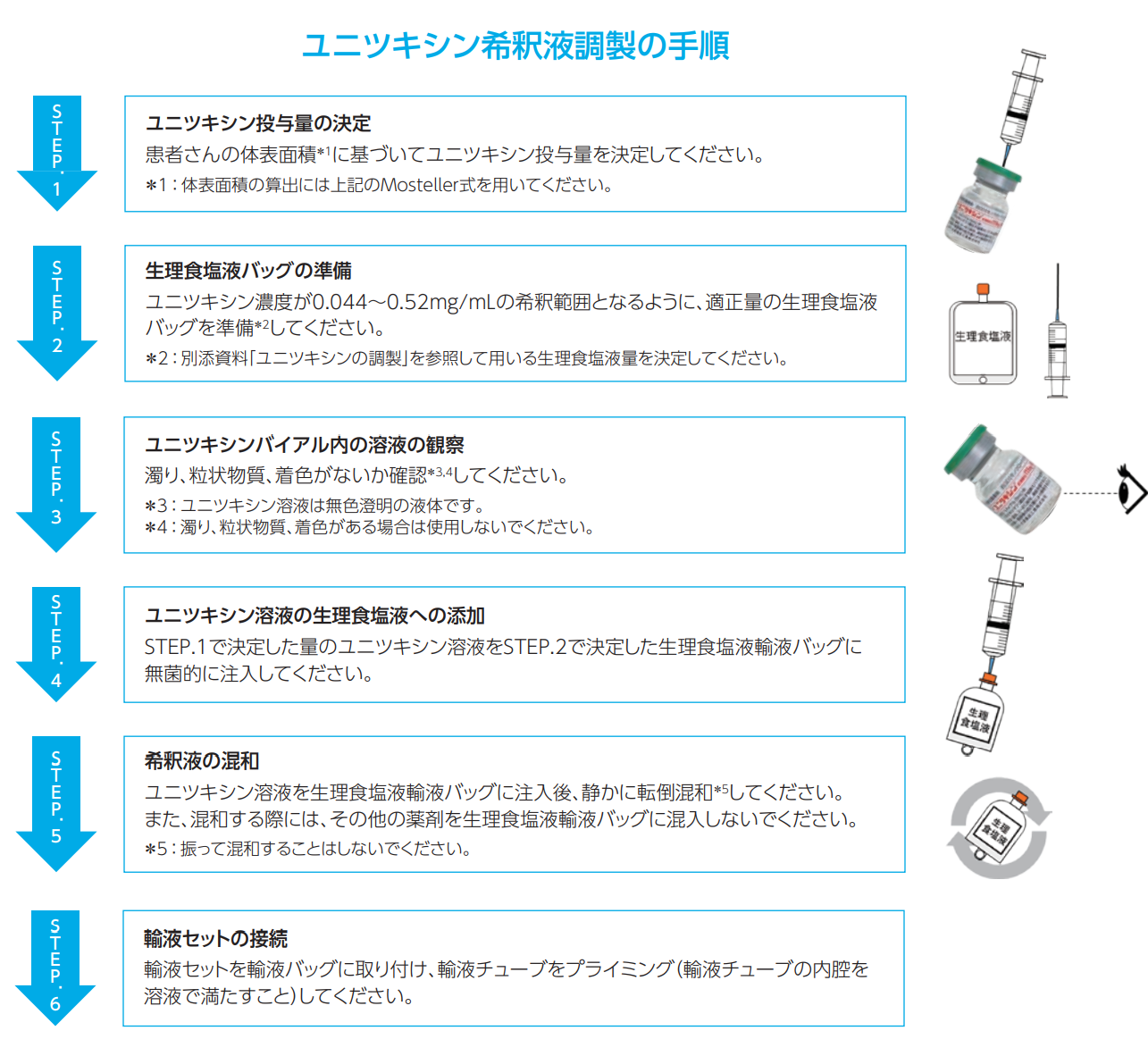
(4)ユニツキシンの調製方法/希釈液調製の手順
各サイクル開始前に毎回、体表面積に基づきユニツキシンの投与量を決定し直してください。
体表面積の算出には小児科領域で最も一般的な以下のMosteller式を用いてください。
体表面積(m2)=([身長(cm)×体重(kg)]/3600)1/2
(本サイト の「使用方法」にある 体表面積算出ツール をお使いください。)
バイアル内の溶液の濁り、粒状物質又は着色が認められた場合は、使用せずに、弊社医薬情報担当者にご連絡ください。
正確な投与量をとり生理食塩液50~250mLに加え、0.044~0.52mg/mLの希釈範囲となるように調製してください。
(ユニツキシンは0.044~0.52mg/mLの濃度において24時間の安定性が認められています。)
希釈の際は、静かに転倒混和し、振らないでください。
ユニツキシンの希釈液は、凍結を避け2~8℃で保存し、調製から4時間以内に投与を開始してください。
ユニツキシンのバイアルは、1回使い切りなので、未使用残液は、適切に廃棄してください。